代表的な論文
全ての論文業績は右欄の「広島大学病院」「Researchmap」を参照ください。
2024
1. Dysregulation of the Hippo pathway enhances PD-L2 transcription to promote cancer immune evasion. Ando T (corresponding author), Okamoto K, Sato K, Goto Y, Izumi H, Kataoka N, Ueda Y, Iglesias-Bartolome R, Yoshimoto T, Shintani T, Yanamoto S, Miyauchi M, Gutkind JS, Kajiya M. preprint, 2024.
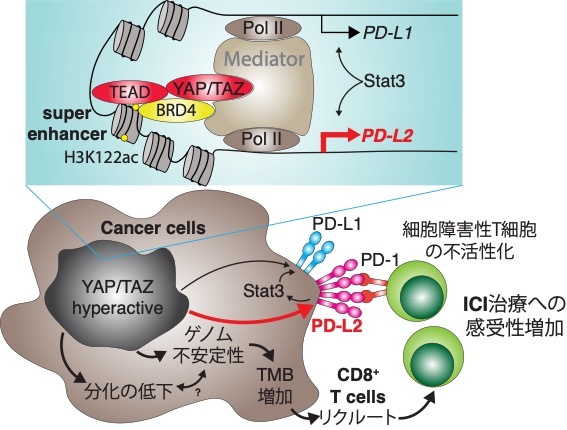
現在はCell Reports Medicineのunder reviewです。
がんは増殖能を高めるだけでなく、周囲の免疫細胞からの攻撃を逃れて増殖しています。これを免疫回避機構と言います。 免疫チェックポイント阻害薬は、がん細胞の免疫回避機構を阻害する薬剤として臨床で用いられています。
口腔・頭頸部扁平上皮癌においてYAP/TAZは異常に活性化しており、増殖・薬剤耐性に重要なことは分かってきましたが、免疫回避に関連するかは未解明でした。
本研究では、Hippo経路の不活性化に関連する遺伝子異常を有する患者が、免疫チェックポイント阻害薬に奏功しやすいことが分かりました。その一因として、YAP/TAZ活性化は分化の低下とゲノムの不安定性亢進を示し、結果的に遺伝子変異量(TMB)を増加させて、周囲に細胞障害性T細胞がリクルートされてきます。しかし、YAP/TAZ活性化は、BRD4と共にsuper enhancerの形成を介してPD-L2の発現量を増加させて、細胞障害性T細胞を不活性化し、免疫回避していることが明らかになりました。この機構が、結果的に免疫チェックポイント阻害薬への感受性を亢進させたと考えられます。
今後、がん微小環境に対するYAP/TAZ活性化の影響を解明していくとともに、PD-L2やYAP/TAZを標的とした新たな創薬開発・治療法開発を進めていきます。
2. YAP/TAZ interacts with RBM39 to confer resistance against indisulam. Ando T (corresponding author), Okamoto K, Ueda Y, Kataoka N, Shintani T, Yanamoto S, Miyauchi M, Kajiya M. Oncogenesis, 13(1):25, 2024
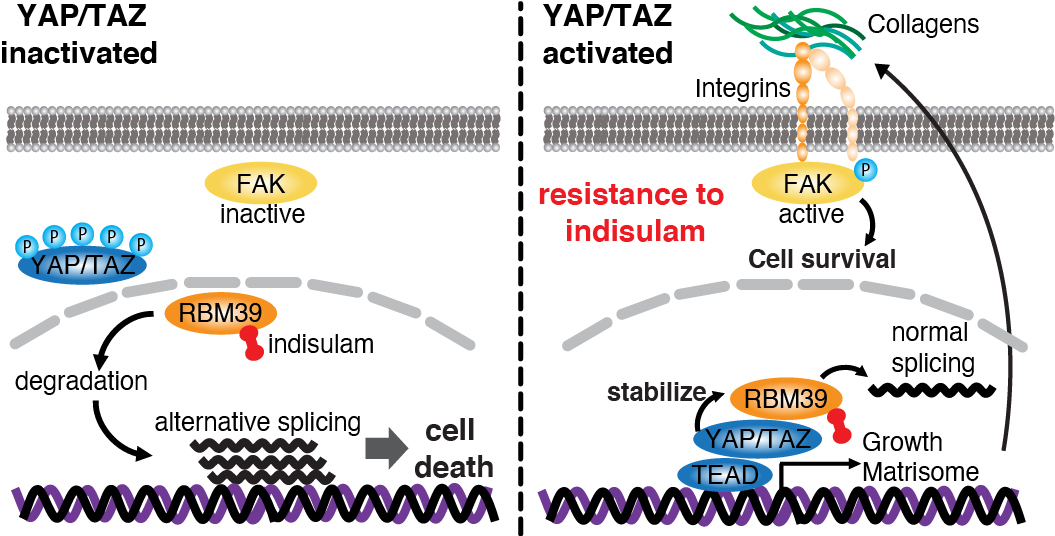
口腔・頭頸部扁平上皮癌においてYAP/TAZは活性化しており、 核内移行しています。しかしながら、核内においてYAP/TAZがどのような因子と相互作用しているか、その全貌はまだ解明されていません。本研究ではYAPの新たな核内相互作用因子を探索し、RBM39を同定しました。
RBM39はRNA結合タンパクの一つであり、転写因子の転写活性を亢進し、またmRNAの正常なスプライシングを制御しています。Indisulamはアリルスルホンアミドの一つです。IndisulamはRBM39をユビキチンリガーゼに結合させて、分解させます。それゆえに異常なスプライシングが生じ、細胞死に至ります。しかし、臨床治験においては期待ほどの効果が得られず、耐性機構の解明が望まれていました。また、Indisulamは異常なスプライシングを引き起こすことでネオアンチゲンの産生も促し、免疫チェックポイント阻害薬の効果を向上させることも報告されています。将来的な応用が期待されていますが、やはり耐性機構を解明しない限り、免疫チェックポイント阻害薬との併用効果も限局的になってしまうと予想されます。
本研究では、YAPがRBM39に結合し、1) YAP/TAZ標的遺伝子の転写を促すこと、2) indisulamによるRBM39の分解を妨げることを明らかにしました。YAP/TAZの活性化はintegrin/collagenの産生を促してFAKを活性化させ、また細胞周期やDNA代謝に重要な遺伝子の異常スプライシングも阻害できるため、indisulamへの耐性を付与することを解明しました。
多くの固形がんでYAP/TAZの活性化が生じていることを考えると、Indisulamが治験で奏功しにくかった理由が分かります。したがってRBM39とYAP/TAZ相互作用を回避できるような新たな創薬の開発が今後の課題となります。
DOI: 10.1038/s41389-024-00527-0
2023
1. AXL activates YAP through the EGFR–LATS1/2 axis and confers resistance to EGFR-targeted drugs in head and neck squamous cell carcinoma, Okamoto K, Ando T (corresponding author), Izumi H, Kobayashi SS, Shintani T, Gutkind JS, Yanamoto S, Miyauchi M, Kajiya M. Oncogene, 42:2869-2877, 2023.
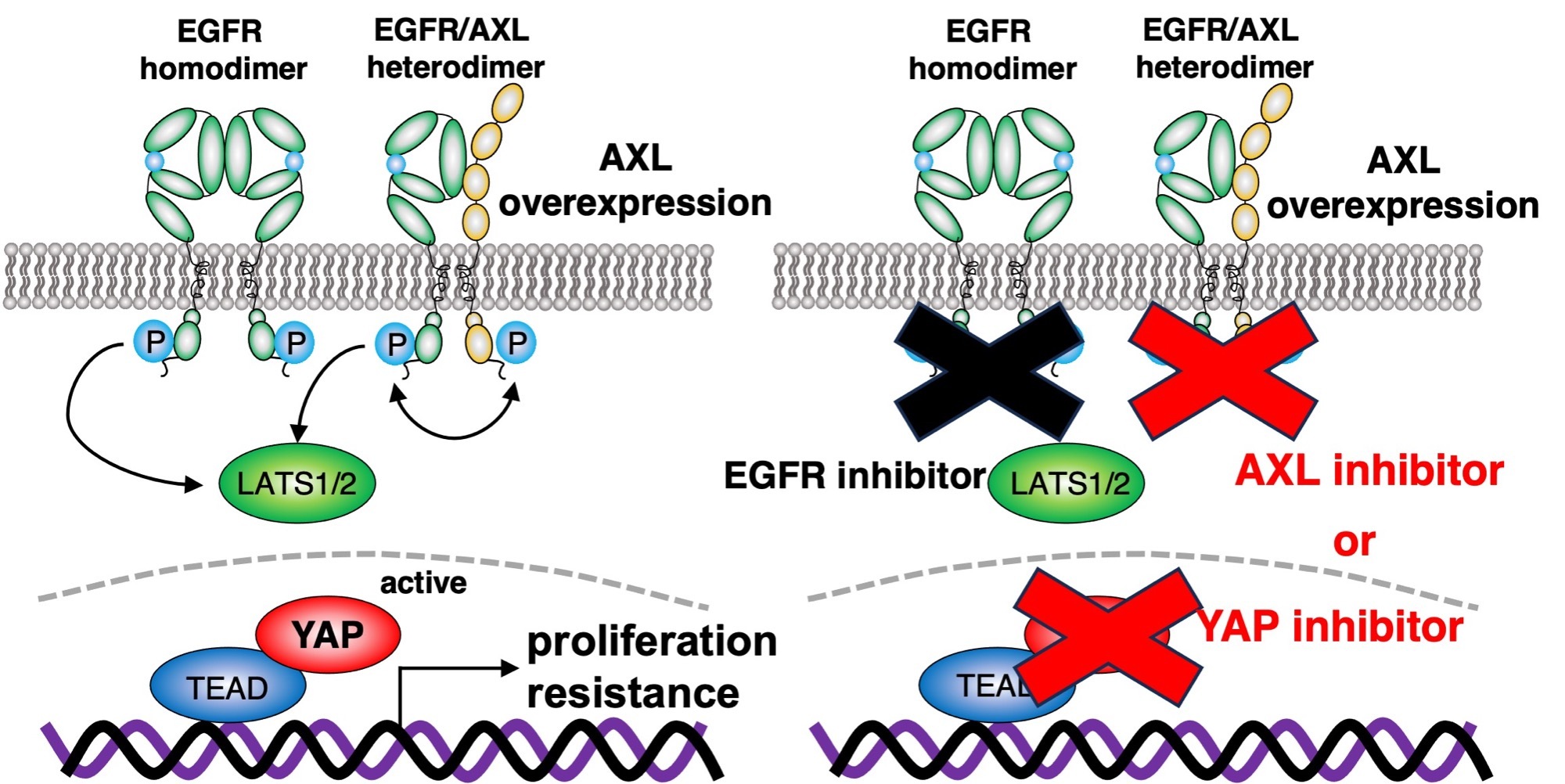
受容体チロシンキナーゼのEGFRはYAPを活性化させ
ますが、EGFR阻害薬の効果が限定的なのはなぜでしょ
うか。EGFR阻害薬に耐性を示す症例でYAPの再活性化が
生じることから、別の受容体型チロシンキナーゼが関与
していると考えました。データベース解析から新たにAXL
を同定しました。AXLはEGFRとヘテロ二量体を形成し、
EGFR-LATS1/2を介してYAPを活性化させる機構を明
らかにしました。EGFR阻害薬の耐性を解除するため、
AXL阻害薬を併用することが重要であることが示されま
した。
EGFR阻害薬とAXL阻害薬の併用、あるいは新たな治
療戦略の開発が今後必要とされます。
Readers Choice: The best of Oncogene 2023に選ばれました(2024年1月9日)!
DOI: 10.1038/s41388-023-02810-7
(Springer Nature Sharedit Initiativeのリンク)
2021
1. EGFR Regulates the Hippo pathway by promoting the tyrosine phosphorylation of MOB1. Ando T, Arang N, Wang Z, Costea DE, Feng X, Goto Y, Izumi H, Gilardi M, Ando K, Gutkind JS. Communications Biology, 4:1237, 2021.
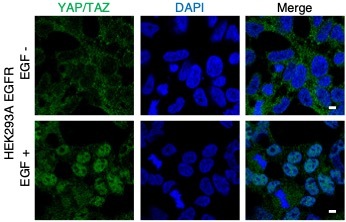
受容体チロシンキナーゼのEGFRはリガンドEGFと結合することで活
性化し、下流シグナル経路を活性化させて増殖を促します。頭頸部扁
平上皮癌では遺伝子増幅・過剰発現し、肺腺癌ではおよそ50%が活性
化変異を示します。EGFRとYAP/TAZの関連については詳細が分かっ
ていませんでした。本論文では、EGFRがHippo構成要素の一つである
MOB1の3箇所のチロシン残基のリン酸化を促すことで、LATS1/2の不
活性化を引き起こし、YAP/TAZを活性化させてがん細胞の増殖を促す
機構を世界で初めて解明しました。
歴史的に昔からよく知られていたEGFRが、まだ発見されてから歴史
的に浅いシグナル経路であるHippo経路を制御していました。この点
が今回のシグナル研究としての面白さとインパクトの大きさを象徴して
います。
DOI: 10.1038/s42003-021-02744-4
2019
1. The transition of tissue inhibitor of metalloproteinases from -4 to -1 induces aggressive behavior and poor patient survival in dedifferentiated liposarcoma via YAP/TAZ activation. Shrestha M, Ando T (equally contributed with 1st author), Chanbora C, Sakamoto S, Nishisaka T, Ogawa I, Miyauchi M, Takata T. Carcinogenesis, 40(10):1288-1297, 2019.
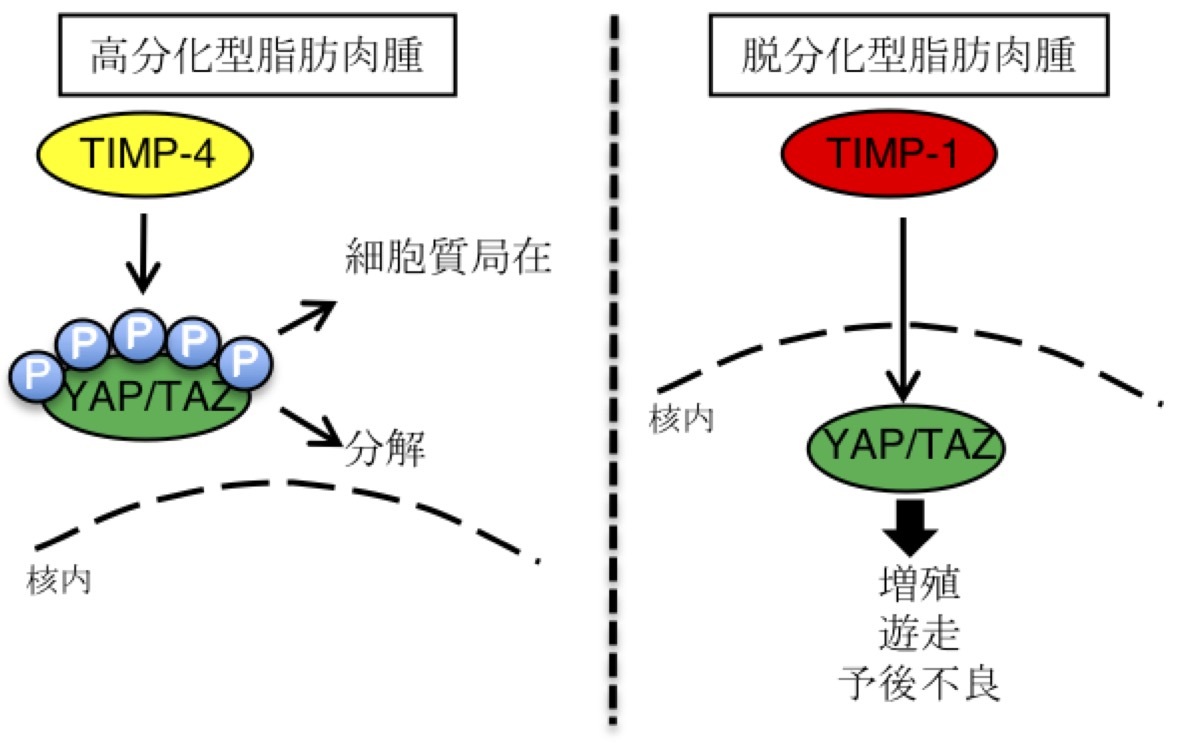
脂肪肉腫は南部組織で最も好発するがんです。脂肪細胞を由来として発生し、良好な予後を示す高分化型と予後不良な脱分化型があります。
TIMP-4はTIMP familyの一つの分泌蛋白です。私は以前、TIMP-1がYAP/TAZを活性化させることを明らかにしていました。しかしその他のTIMPに関してはYAP/TAZを制御するかは不明でした。興味深いことに、TIMP-4は正常の脂肪細胞に多く発現しており、脂肪肉腫においても何らかの機能を有していると考えました。
本研究では、TIMP-4が高分化型脂肪肉腫に高発現し、TIMP-1が脱分化型脂肪肉腫に高発現することを見出しました。TIMP-4は高分化型脂肪肉腫においてYAP/TAZを不活性化させており、増殖、遊走能を抑制していました。一方、TIMP-1は脱分化型脂肪肉腫に高発現し、YAP/TAZを活性化させて、増殖・遊走を促し、予後不良へと繋がっていることが明らかになりました。今後、TIMP-1, TIMP-4, YAP/TAZを標的とした治療の開発が期待されます。
https://doi.org/10.1093/carcin/bgz023
2018
1. Tissue inhibitor of metalloproteinase-1 promotes cell proliferation through YAP/TAZ activation in cancer. Ando T, Charindra D, Shrestha M, Umehara H, Ogawa I, Miyauchi M, Takata T. Oncogene, 37(2):263-270, 2018.
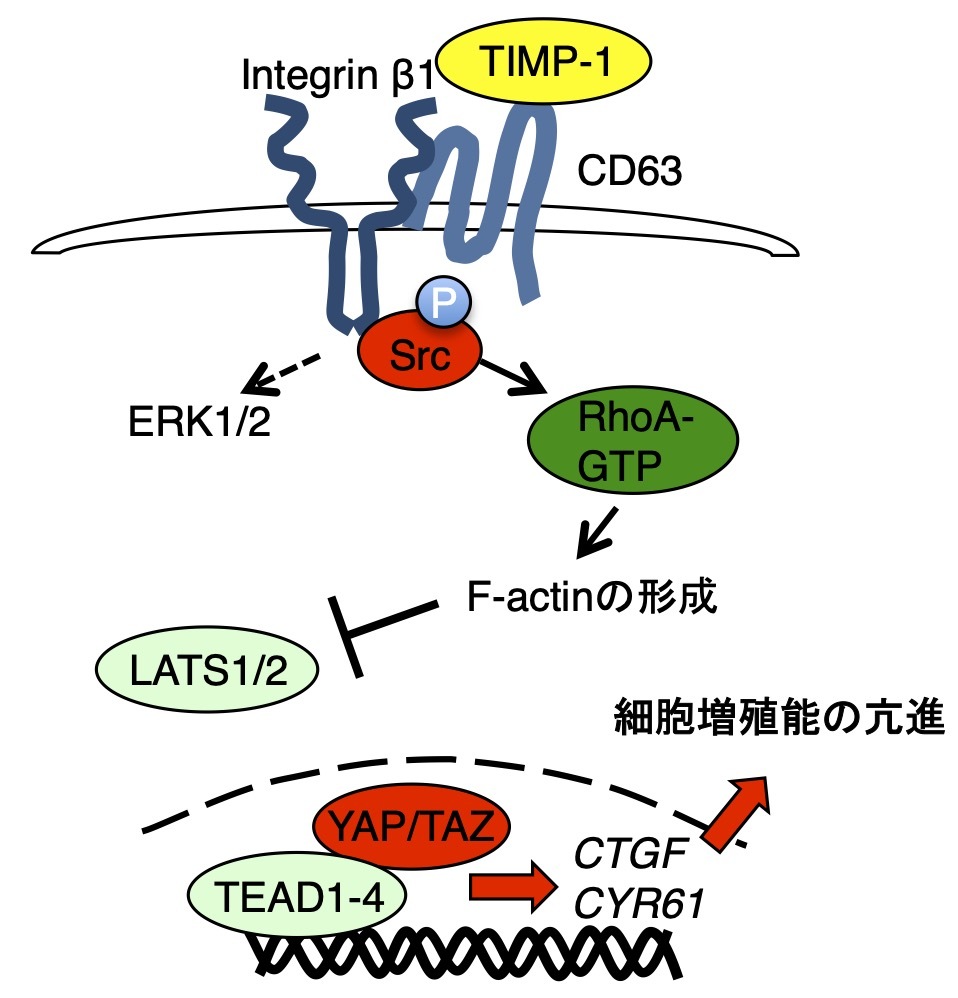
Tissue inhibitor of metalloproteinase-1(TIMP-1)は、TIMP familyの一つで分泌蛋白です。がんでは過剰に発現しています。元々、がんはmatrix metalloproteinase(MMP)を産生し、がん細胞周囲の基質を破壊しながら浸潤増殖しています。したがってTIMP-1の機能はMMPを抑制することから、がんの浸潤増殖を抑えると考えられていました。しかし、TIMP-1は多くのがんで高発現しており、むしろがんの増殖・浸潤転移・予後不良と正の相関を示すことから、がん促進因子としての新たな機能があるのではないかと注目されていました。確かに、TIMP-1はCD63を受容体とし、Integrinβ1やSrcと会合し、下流のシグナル経路を活性化させて増殖を促進するようでしたが、Hippo経路・YAP/TAZと関連するかは不明でした。
この論文では、TIMP-1がHippo経路の抑制とYAP/TAZの活性化を導いてがんの増殖を促す新たな機構を解明しました。TIMP-1はCD63/Integrinβ1/Srcとcomplexを形成した後、RhoAの活性化、F-actinの形成を促すことで、LATS1/2を不活性化し、YAP/TAZを活性化させます。口腔・頭頸部扁平上皮癌を含む様々ながんでTIMP-1がYAP/TAZの活性化を生じるが明らかになり、新たな治療開発の重要性が示されました。
https://doi.org/10.1038/onc.2017.321
2017
1. Ameloblastin induces tumor suppressive phenotype and enhances chemosensitivity to doxorubicin via Src-Stat3 inactivation in osteosarcoma. Ando T, Kudo Y, Iizuka S, Tsunematsu T, Umehara H, Shrestha M, Matsuo T, Kubo T, Shimose S, Arihiro K, Ogawa I, Ochi M, Takata T. Scientific Reports, 7:40187, 2017.
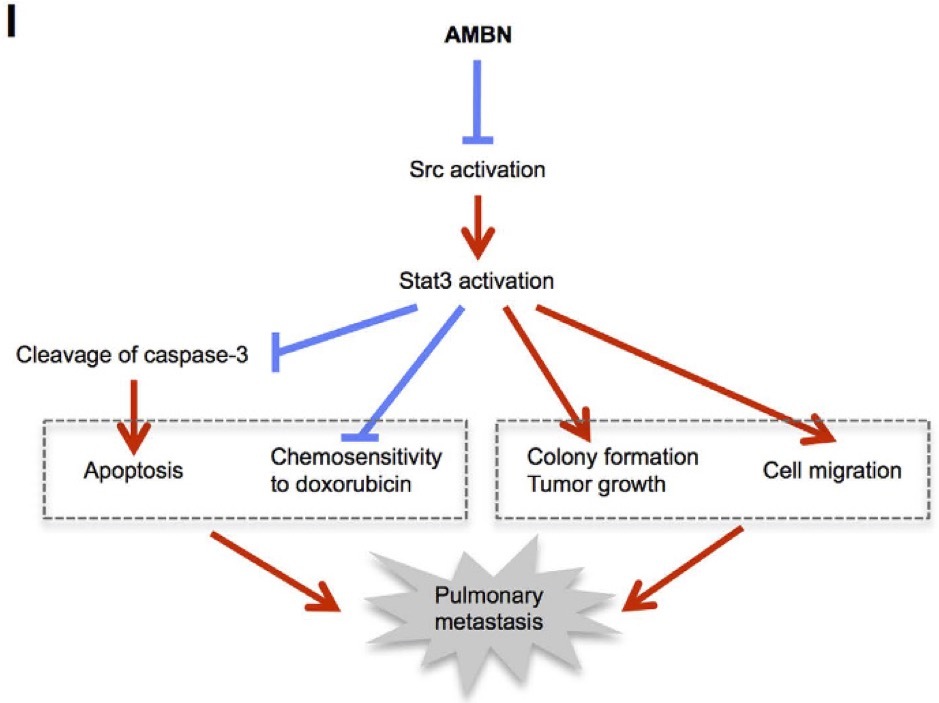
Ameloblastin (AMBN) は非アメロゲニンエナメルマトリックスタンパクの中で最も豊富であり、エナメル芽細胞の分化に重要です。さらに、AMBNがCD63, Integrinβ1と会合し、Srcを不活性化させることで骨芽細胞の分化も抑制することが明らかになってきました。
骨肉腫は悪性の骨原発腫瘍であり、予後不良の疾患です。骨芽細胞から発生すると考えられていますが、骨芽細胞の発現するAMBNは骨肉腫の病態と関連するのでしょうか。その関係性を明らかにするために研究を行いました。本研究により、骨肉腫細胞におけるAMBNの高発現は、Src-Stat3経路を抑制することで、アポトーシスの誘導、コロニー形成能・腫瘍形成能の抑制、細胞遊走の抑制、およびドキソルビシンへの感受性を亢進させることが明らかになりました。また骨肉腫におけるAMBNの発現量は、患者の予後良好と正の相関を示しました。以上より、骨肉腫におけるAMBNの腫瘍抑制的な役割が明らかになりました。今後骨肉腫におけるAMBNの予後予測因子としての役割とともに、新たな治療標的となることが示唆されます。
https://doi.org/10.1038/srep40187




