なぜシグナル経路を研究するのか?
細胞内では様々なシグナル経路が存在しています。例えば正常の細胞において、細胞外からの生存シグナル(例えばリガンド)を受容体が受け取ることで、細胞内の分子がリン酸化されて活性化し、さらに次の分子をリン酸化することで連続的に刺激を伝えていきます。最終的には増殖・生存に必要な遺伝子の転写が促進されることで、増殖が亢進します。特にがんでは様々なシグナル経路が活性化・不活性化されており、異常な増殖が生じています。このシグナル経路の異常を引き起こす大元となるのは「遺伝子異常」です。がんでは遺伝子異常(変異、増幅、欠失、融合遺伝子など)が生じることで、増殖を促す遺伝子(がん遺伝子)の活性化、増殖を普段は抑制しているはずの遺伝子(がん抑制遺伝子)の不活性化が生じることで、下流シグナル経路の異常が生じています。遺伝子異常の中にはあまり増殖・生存に関係のないものもあります(パッセンジャー変異)、一方で増殖に極めて重要なもの(ドライバー変異)もあります。ドライバー変異および下流シグナルを抑制することで、正常細胞にはできるだけ影響を与えず、がん細胞だけ攻撃できる薬剤ができないか?その考えに基づいて登場したものが「分子標的薬」となります。今では多くの分子標的薬が登場し、がん治療において重要な治療薬に位置付けられています。また近年登場した免疫チェックポイント阻害薬は、がん細胞による免疫細胞の抑制メカニズムを標的とした分子標的薬の一つと言えます。例えば、がん細胞の発現するPD-L1とT細胞の発現するPD-1をブロックすることで、T細胞の活性化を促すことで抗腫瘍効果が得られます。口腔・頭頸部扁平上皮癌では遺伝子増幅・過剰発現しているEGFRを標的としたCetuximab(抗EGFR抗体)が承認されており、免疫チェックポイント阻害薬としてはNivolumab, Pembrolizumabの2種類の抗PD-1抗体が使用されています。
さらに2019年からは日本全国でがんゲノム医療が始まりました。次世代シークエンサーを用いてがん細胞の遺伝子異常を特定することで、ドライバー変異を示す分子あるいは下流シグナル経路を阻害する分子標的薬を用いた治療法の選択が可能になりました。これまでは分子標的薬の選択には臓器による壁が存在しており、がんが発生した臓器において承認された薬剤しか使用できませんでした。しかし、がんゲノム医療は臓器毎の壁を低くし、遺伝子異常に基づいて治療を選択できるようになります。Precision medicineに近づいていると言えます。
しかしながら、問題点が一つあります。遺伝子異常を特定しても、下流シグナル経路が十分に理解できていない、あるいは分子標的薬が開発されていなければ、治療に結びつけることができません。
だからこそ、どのような遺伝子異常が、どのシグナル経路を制御しているのか、これを詳細に研究して明らかにしていくことが非常に重要なのです。遺伝子異常とシグナル経路の異常を繋ぐ研究があってこそ、将来の分子標的治療薬の開発に繋がり、最終的な患者への治療に繋がります。
Hippo経路とはどのようなシグナル経路か?
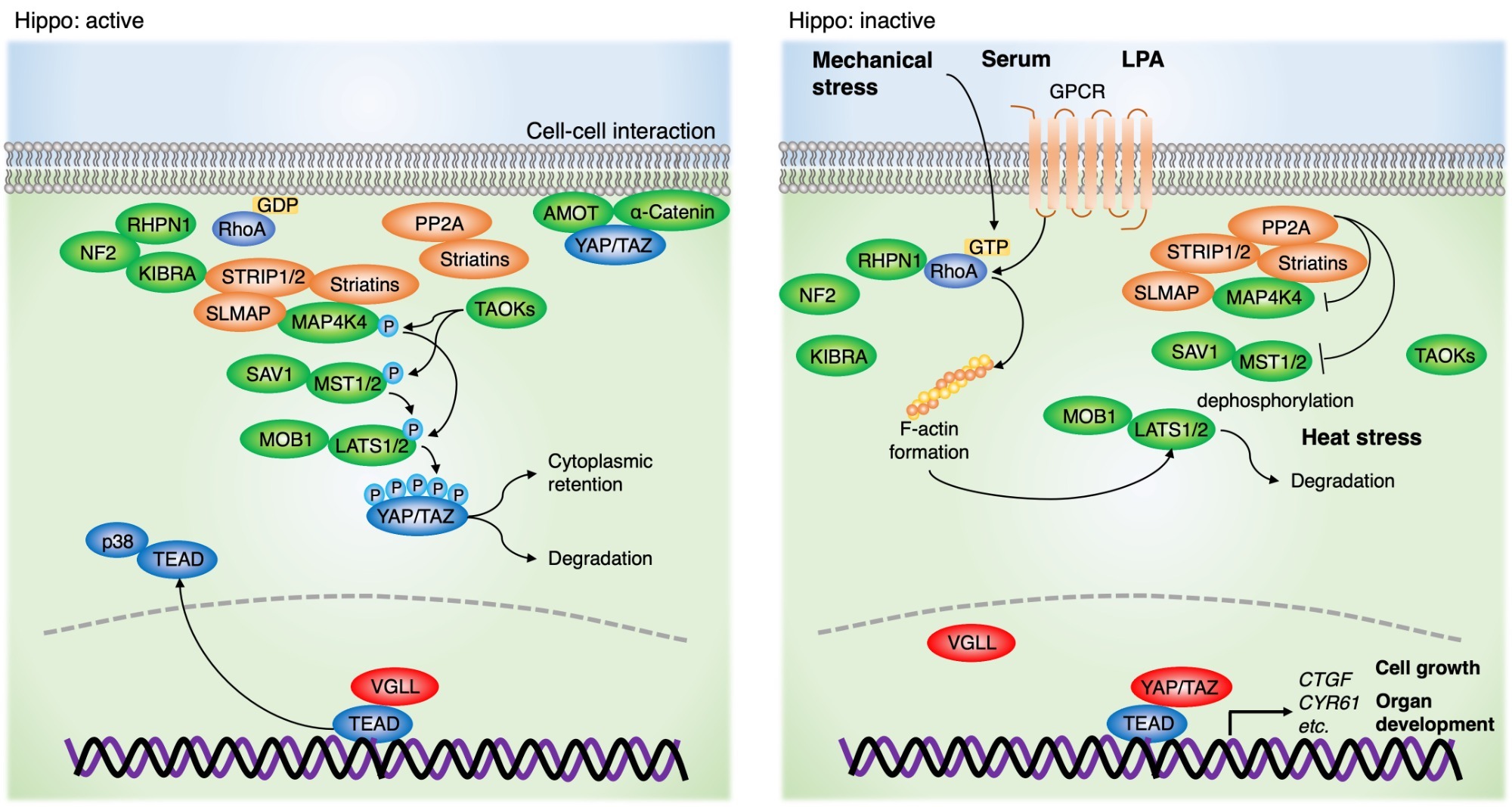
上記画像の引用元:Integrating Genetic Alterations and the Hippo Pathway in Head and Neck Squamous Cell Carcinoma for Future Precision Medicine. Ando T (corresponding author), Okamoto K, Shintani T, Yanamoto S, Miyauchi M, Gutkind JS, Kajiya M. 12(10):1544, 2022.
Hippo経路は、細胞の増殖、組織・臓器の形成において中心的な役割を担うシグナル経路です。Hippo経路は主にmammalian STE20-like kinase 1 and 2 (MST1/2) とlarge tumor suppressor 1 and 2 (LATS1/2) のセリン・スレオニンキナーゼと、それぞれのアダプタータンパクであるsalvador homolog 1 (SAV1) とMOB kinase activators 1A and 1B (MOB1A/B) で構成されています。Hippo経路の下流にはYes-associated protein (YAP) とtranscriptional co-activator with PDZ binding motif (TAZ) が位置しています。Hippo経路が活性化する際には、LATS1/2がYAP/TAZの5箇所のセリン残基をリン酸化することで、細胞質内局在あるいはユビキチン・プロテアソームによる分解へと誘導します。一方、Hippo経路が不活性化する際には、脱リン酸化されたYAP/TAZが核内に移行して転写因子であるTEA domain family members (TEAD) と結合し、共転写因子として働くことで、connective growth factor (CTGF) やcysteine-rich angiogenic inducer 61 (CYR61) など増殖関連遺伝子の転写を亢進します。Hippo経路とYAP/TAZは、細胞密度、メカニカルストレス、血清などの生理的条件下において制御されています。またGPCR、受容体型チロシンキナーゼなども上流因子として制御しています。
口腔・頭頸部扁平上皮癌におけるHippo経路の意義とは?

私は、口腔・頭頸部扁平上皮癌において様々な遺伝子異常がHippo経路の不活性化によるYAP/TAZの活性化を引き起こしていることを明らかにしてきました。
Tissue inhibitor of metalloproteinase-1 (TIMP-1) が口腔・頭頸部扁平上皮癌において過剰発現しており、CD63/Integrinを介してYAP/TAZを活性化させて増殖を促すことを明らかにしました(Ando T et al, Oncogene, 2017)。
Epidermal Growth Factor Receptor (EGFR) は、リガンドであるEGFが結合することでホモ二量体を形成し、自己リン酸化して下流シグナル経路を活性化し、増殖を促します。EGFRは口腔・頭頸部扁平上皮癌では遺伝子増幅・過剰発現しています。EGFRはMOB1の3箇所のチロシン残基のリン酸化を促すことで、LATS1/2を不活性化し、YAP/TAZを活性化させて増殖を促進することを明らかにしました(Ando T et al, Commun Biol, 2021)。
EGFR阻害薬は口腔・頭頸部扁平上皮癌で分子標的薬として用いられていますが、その奏功率は低く、耐性が問題となっていました。また耐性には別の受容体型チロシンキナーゼ(RTK)の高発現やYAP再活性化が報告されていました。そこで、確かにEGFR阻害薬は一過性にYAPを不活性化しうるが、何らかのRTKが高発現し、YAPの再活性化を引き起こすことで耐性獲得に寄与しているのではないかと考えました。その新たなRTKとしてAXLを同定しました。AXLはEGFR-LATS1/2を介してYAPを活性化させます。EGFR阻害薬にAXL阻害薬を併用することで、YAPの強力な不活性化と増殖抑制を導くことを示しました。よって、将来的にEGFR阻害薬とAXL阻害薬の併用、あるいはYAP標的薬を用いた治療法開発の重要性を明らかにしました(Okamoto K et al, Oncogene, 2023)。
YAP/TAZは活性化して核内に移行した後も、さらに核内因子と相互作用することが近年注目されていますが、口腔・頭頸部扁平上皮癌での特有の相互作用因子は分かっていません。そこで検討したところ、RNA結合タンパクの一つであるRBM39を同定しました。RBM39はYAPと結合することでYAP/TEADの転写活性を亢進します。一方、indisulamというRBM39の分解を促す薬剤は、RBM39を分解させることで転写活性の低下とともに、異常なスプライシングを誘導して細胞死を引き起こします。しかし、YAPがRBM39に結合することで、indisulamの分解が遅延し、転写活性の低下が生じず、また異常なスプライシングの誘導も生じませんでした。つまり、YAPとRBM39はindisulamに対する耐性を付与しました。今後、相互作用部位の解析を進めて、相互作用を標的とした創薬開発につなげていきます(Ando T et al, Oncogenesis (under revision), 2024)。
がん細胞が増殖するためには免疫細胞からの攻撃を防ぐあるいは回避する必要があります(免疫回避)。がん細胞は遺伝子異常を有することで遺伝子変異量(TMB)が高いほどネオアンチゲンを産生し、細胞障害性 T細胞からの攻撃を受けますが、PD-L1を発現することで、細胞障害性T細胞のPD-1を介して不活性化させ、免疫回避を行っています。しかし、Hippo経路と免疫回避機構の関連の詳細は分かっていませんでした。私は、Hippo経路に遺伝子異常を有する患者は免疫チェックポイント阻害薬(抗PD-1抗体)への感受性が高いことを見出しました。YAP/TAZ活性化はがん細胞の遺伝子不安定性を惹起することでTMBを増加させて、細胞障害性T細胞をリクルートします。しかし、YAP/TAZはPD-L2の転写を促進することで、免疫回避を行っています。これらが免疫チェックポイント阻害薬への感受性亢進に寄与している可能性が考えられます。今後、さらにがん微小環境への影響を探索していく予定です(Ando T et al, Cell Reports (under review), 2024), 。
以上のように、Hippo経路の不活性化を導く遺伝子異常は解明されつつありますが、全貌解明のためにさらなる研究が必要です。
Hippo経路・YAP/TAZを標的としたがんの診断・治療法開発に向けて
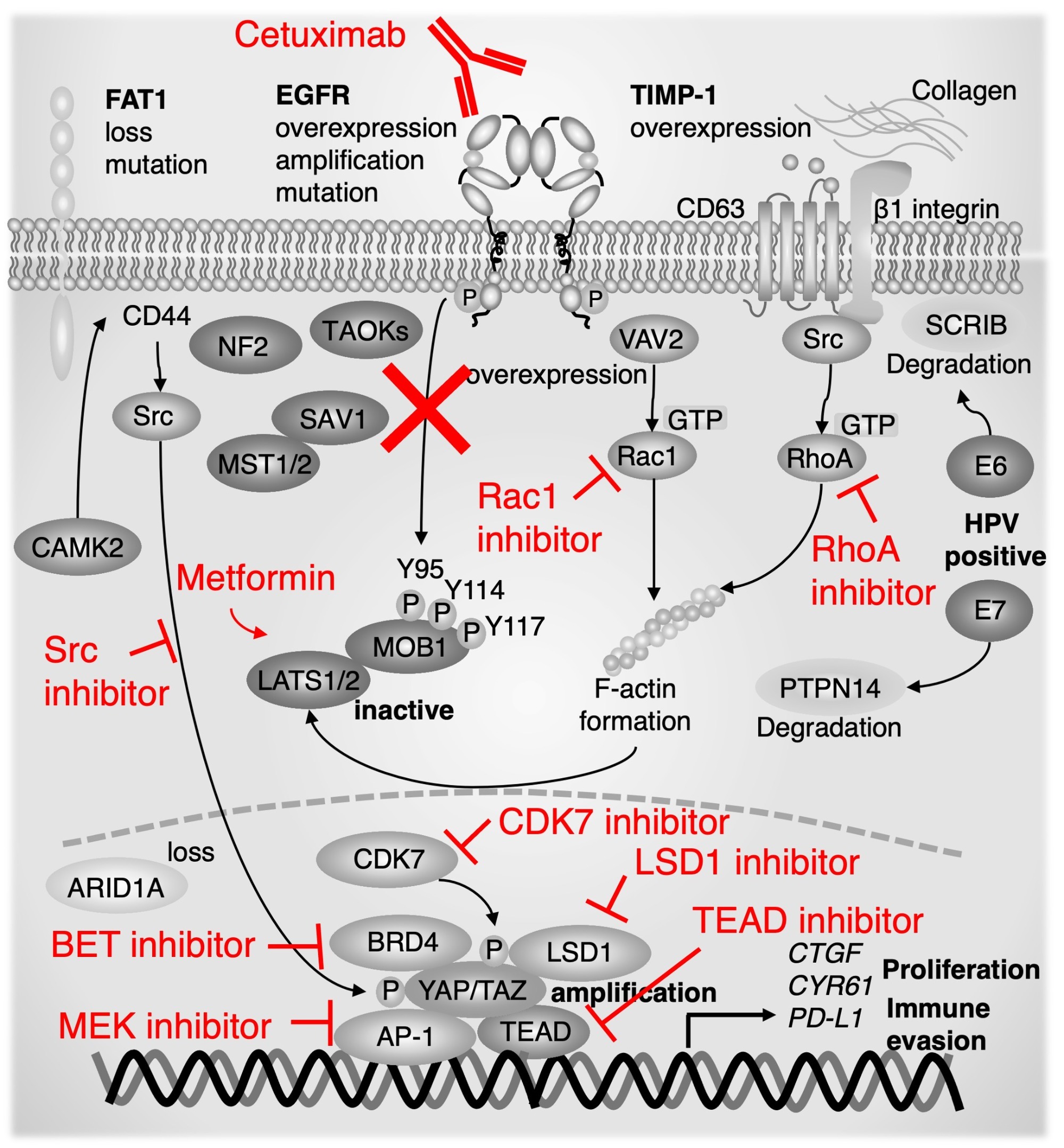
右記画像の引用元:Integrating Genetic Alterations and the Hippo Pathway in Head and Neck Squamous Cell Carcinoma for Future Precision Medicine. Ando T (corresponding author), Okamoto K, Shintani T, Yanamoto S, Miyauchi M, Gutkind JS, Kajiya M. 12(10):1544, 2022.
どのような遺伝子異常がHippo経路の不活性化を導くか、この詳細な機構の全貌は残念ながらまだ明らかになっていません。
したがって、がんゲノム医療で得られる遺伝子異常の中には、Hippo経路・YAP/TAZの異常を引き起こすかもしれないが、まだ明らかになっていないため治療に結びつかないものが含まれている可能性があります。またHippo経路の不活性化を導くと分かっている遺伝子異常が同定できたとしても、現状ではHippo経路・YAP/TAZを標的とする分子標的治療薬が存在していません。有力な候補としては、TEAD阻害薬があります。YAP/TEADの結合部位が同定されて、TEADのポケットに化合物が入り込み、両者の結合を解離させます。
私は、遺伝子異常とHippo経路・YAP/TAZを繋ぐメカニズムを明らかにすること、そしてさらにHippo経路・YAP/TAZを標的とする次世代のがんの診断・治療薬の研究開発に現在も取り組んでいます。




